Comment les laboratoires étendent leur monopole grâce aux brevets de formulation
Un médicament qui marche bien, c’est une source de revenus. Mais ce monopole ne dure pas éternellement. Le brevet principal expire après 20 ans, et les génériques peuvent alors entrer sur le marché. Pourtant, certains médicaments restent protégés 10, 15, voire 16 ans après cette date. Comment ? Grâce à des brevets de formulation sur les combinaisons.
Il ne s’agit pas de nouveaux ingrédients actifs. Ce sont des combinaisons déjà connues, mais arrangées différemment : des doses précises, un mode de libération modifié, une nouvelle forme d’administration. Et ces petits changements, même minimes, peuvent suffire à bloquer les génériques pendant des années.
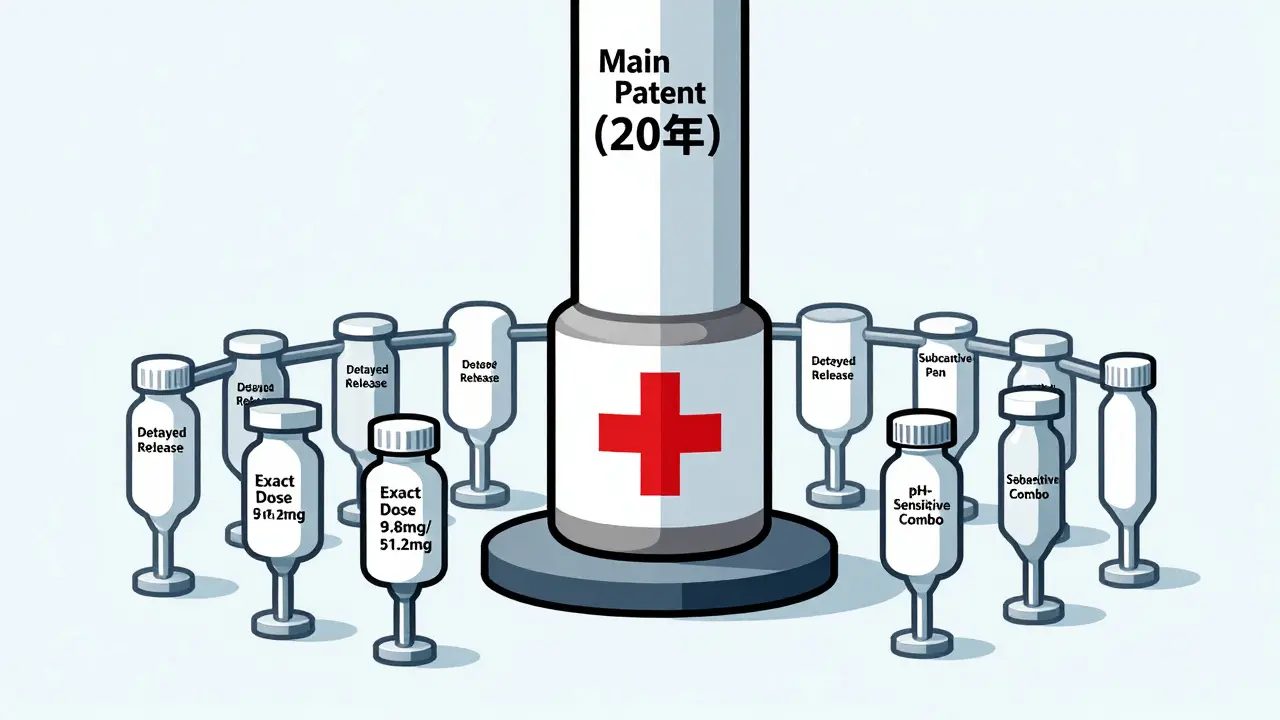
Le piège du « picket fence » : une clôture de brevets autour d’un seul produit
Imaginez un champ. Le brevet principal, c’est le grand poteau au milieu. Autour, les laboratoires plantent une série de petits poteaux : un pour la dose exacte, un autre pour le comprimé à libération prolongée, un troisième pour le stylo injectable, un quatrième pour la combinaison avec un autre médicament. C’est ce qu’on appelle la « clôture de piquets » (picket fence). Chaque poteau est un brevet secondaire. Quand le premier tombe, les autres tiennent encore.
Cette stratégie est devenue standard dans l’industrie. Selon l’USPTO, 78 % des nouveaux médicaments approuvés entre 2015 et 2020 incluaient au moins un brevet de formulation ou de combinaison. Ce n’est pas une exception : c’est la règle. Des produits comme Phesgo® (Roche), une combinaison de trastuzumab et de pertuzumab en injection sous-cutanée, ont réussi à remplacer les perfusions intraveineuses traditionnelles, rendant les génériques moins attractifs même après l’expiration du brevet principal.
Les brevets de formulation : entre innovation et manipulation
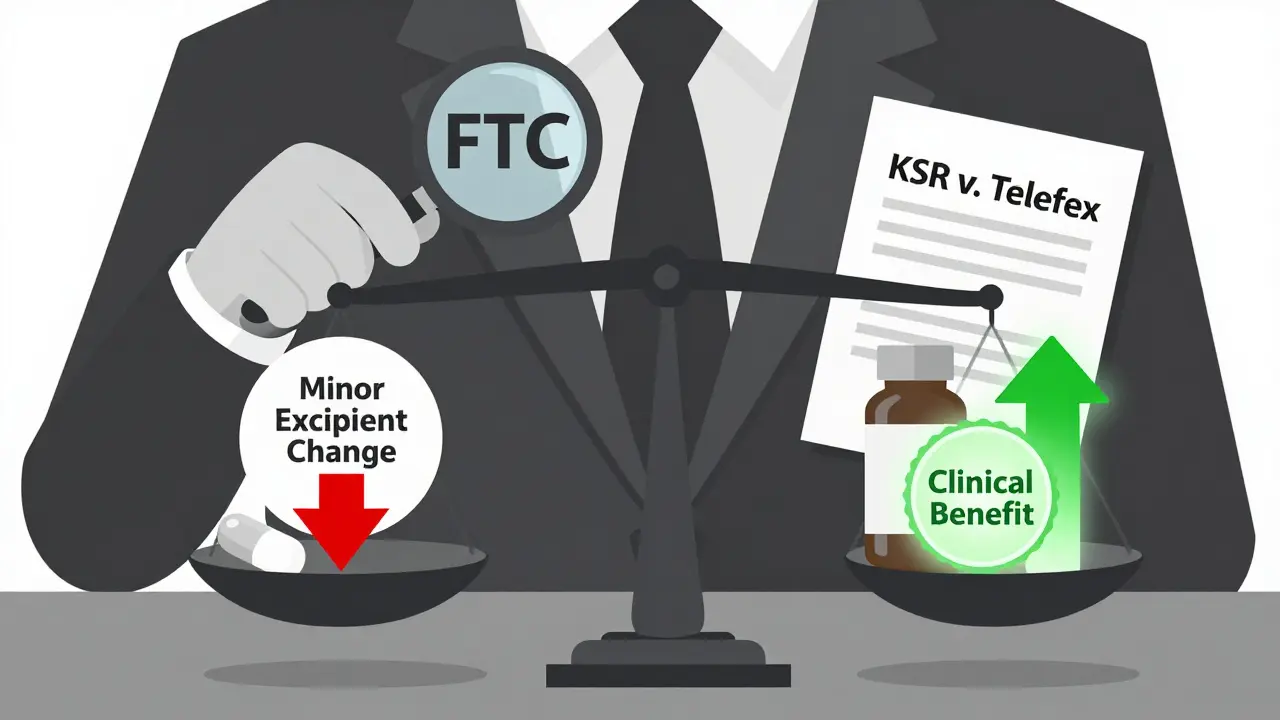
Pour obtenir un tel brevet, il ne suffit pas de mélanger deux médicaments. Les examinateurs appliquent un test d’obviousness - « est-ce évident ? » - depuis la décision de la Cour suprême américaine KSR contre Teleflex en 2007. Si vous combinez deux molécules connues pour traiter la même maladie, vous êtes presumé coupable d’obviousité… sauf si vous prouvez un résultat inattendu.
Qu’est-ce qu’un résultat inattendu ?
- Une efficacité supérieure de 30 % avec une dose plus faible
- Une réduction de 50 % des effets secondaires
- Une libération contrôlée qui permet une prise quotidienne au lieu de trois fois par jour
- Une stabilité accrue à température ambiante, supprimant le besoin de réfrigération
Des études montrent que les brevets de formulation doivent démontrer une amélioration statistiquement significative (p < 0,01) pour être validés. Cela demande des essais cliniques coûteux : entre 15 et 25 millions de dollars en plus, selon les données de Foley & Lardner. Ce n’est pas une simple réinvention : c’est une course scientifique.
Les chiffres qui dévoilent la réalité
Les données sont claires :
| Caractéristique | Brevet principal | Brevet de formulation sur combinaison |
|---|---|---|
| Durée de protection | 20 ans (à partir du dépôt) | 20 ans, mais souvent prolongé par extension de terme |
| Exclusivité après approbation | 12-14 ans en moyenne | 3 à 8 ans supplémentaires |
| Taux d’invalidation | 22 % | 38 % |
| Coût de développement supplémentaire | 1,2 à 2,6 milliards de dollars | 15 à 42 millions de dollars |
| Taux d’approbation (2022) | N/A | 58 % en oncologie, 43 % en neurologie |
Les combinaisons dans les domaines de l’oncologie et des maladies rares réussissent mieux. Pourquoi ? Parce que les besoins sont complexes : les patients ont besoin de traitements précis, de dosages ajustés, de modes d’administration plus faciles. Les brevets dans ces secteurs sont plus difficiles à contourner.
En revanche, dans les maladies chroniques comme le diabète ou l’hypertension, les génériques trouvent plus facilement des chemins de contournement. Le cas de Revlimid® en 2021 montre comment des fabricants de génériques ont obtenu l’autorisation pour des indications non protégées, même si la combinaison principale était brevetée.
Le piège de l’« evergreening » : prolonger l’exclusivité sans améliorer la santé
Le plus gros débat ne porte pas sur la technique, mais sur l’éthique. Est-ce une innovation ou une manipulation ?
Le FTC (Commission fédérale du commerce) accuse certains laboratoires de « product hopping » : ils déclarent officiellement la version ancienne obsolète, la retirent du marché, et poussent les médecins à prescrire la nouvelle version brevetée - même si les bénéfices pour le patient sont minimes. C’est ce qui s’est passé avec l’oxaliplatin, où une simple modification de l’excipient a suffi à bloquer les génériques pendant des années.
Le Dr Aaron Kesselheim, de l’Université Harvard, a qualifié cette pratique dans le JAMA Internal Medicine de « patent privateering » : exploiter le système de brevets sans apporter de réel progrès thérapeutique. Selon l’FDA, 31 % des brevets de formulation déposés entre 2015 et 2022 concernaient des changements mineurs : un sel différent, un excipient nouveau, une forme de comprimé légèrement modifiée - sans preuve de meilleure efficacité ou sécurité.
La Commission européenne et le Congrès américain réfléchissent à des réformes. Le projet de loi Preserve Access to Affordable Generics Act vise à exiger une « amélioration clinique significative » pour accorder un brevet de formulation. Si adopté, cela pourrait invalider jusqu’à 28 % des brevets actuels.
Les stratégies gagnantes : précision, données et timing
Les laboratoires qui réussissent ne comptent pas sur la chance. Ils planifient leur stratégie de brevets 5 à 7 ans avant l’expiration du brevet principal. Voici ce qu’ils font :
- Identifier les points faibles du produit original : trop de prises ? Effets secondaires ? Instabilité ?
- Développer une formulation qui corrige un seul de ces points, mais de manière mesurable.
- Conduire des essais cliniques avec un groupe contrôle, en comparant directement la nouvelle version à l’ancienne.
- Écrire des revendications extrêmement précises : « 9,8 mg de A et 51,2 mg de B » au lieu de « environ 10 mg et 50 mg » - les détails comptent.
- Soumettre le brevet à l’Orange Book dans les 30 jours après son délivrance. Oublier ce délai, c’est perdre la protection.
Les entreprises expérimentées, comme Pfizer ou Novartis, ont un taux de rejet de 31 %. Les nouveaux venus, eux, encaissent 62 % de refus. Pourquoi ? Parce qu’ils ne comprennent pas la rigueur requise. Un brevet de formulation n’est pas un simple formulaire. C’est un document scientifique et juridique qui doit résister à des années de contestation.
Le futur : moins d’exclusivité, plus de pression
Le modèle de prolongation par formulation ne va pas disparaître - mais il va changer.
Les défis sont nombreux :
- Les génériques déposent de plus en plus de contestations (842 en 2023, contre 517 en 2020).
- Les tribunaux appliquent des normes plus strictes après KSR.
- La FDA exige désormais des preuves de supériorité clinique pour accorder la protection de 3 ans.
- Le budget de santé public pousse à réduire les coûts : le Congressional Budget Office estime que les réformes pourraient faire économiser 150 milliards de dollars d’ici 2028.
Les laboratoires adaptent leurs stratégies. Roche a déposé en 2023 un brevet pour une combinaison trastuzumab-deruxtecan avec libération sensible au pH - une technologie qui ne peut pas être copiée facilement. Cela a demandé 2,3 ans de recherche supplémentaire, mais pourrait prolonger l’exclusivité de 8,5 ans.
À terme, l’industrie passera de la stratégie du « petit changement » à celle de la « véritable innovation ». Les brevets de formulation ne seront plus une arme de prolongation, mais un outil pour améliorer réellement la vie des patients - ou ils disparaîtront sous la pression réglementaire.
FAQ
Quelle est la différence entre un brevet de composition et un brevet de formulation ?
Le brevet de composition protège une molécule spécifique - c’est le brevet principal. Le brevet de formulation protège une manière précise de combiner deux ou plusieurs molécules déjà connues, avec un dosage, un excipient ou un mode d’administration particulier. Le premier bloque tout usage de la molécule. Le second bloque seulement une version spécifique de la combinaison.
Pourquoi les génériques ne peuvent-ils pas simplement copier la combinaison brevetée ?
Ils peuvent, mais ils doivent prouver que leur version n’enfreint pas le brevet. Si la formulation est protégée par un brevet sur un ratio exact (ex. 9,8 mg/51,2 mg), un générique avec 10 mg/50 mg pourrait être considéré comme une contrefaçon. Pour éviter cela, les fabricants doivent créer une version différente - ce qui demande des essais cliniques coûteux, et donc retarde leur entrée sur le marché.
Est-ce légal de prolonger l’exclusivité de cette manière ?
Oui, tant que le brevet est valide. La loi américaine permet de breveter des améliorations, même mineures. Mais la légalité ne signifie pas l’éthique. De plus en plus d’organismes, comme le FTC ou le Congrès, considèrent que certaines pratiques abusent du système. Des réformes sont en cours pour exiger une preuve de bénéfice clinique réel.
Quels sont les médicaments les plus concernés par cette stratégie ?
Les traitements dans les domaines où la précision est cruciale : l’oncologie (ex. Phesgo®, Revlimid®), les maladies rares, l’immunologie (ex. Enbrel®, Humira®) et les biologiques. Ces médicaments sont complexes, coûteux à développer, et les patients acceptent souvent des formes d’administration plus sophistiquées. Cela crée un terrain fertile pour les brevets de formulation.
Combien de temps dure en moyenne l’extension de protection grâce à un brevet de formulation ?
Entre 3 et 8 ans, en moyenne. Certains produits, comme les formulations d’insuline Humalog d’Eli Lilly, ont obtenu jusqu’à 16 ans d’exclusivité totale grâce à une série de brevets. Mais la tendance baisse : les extensions passent de 5,3 ans (2020-2023) à 3,8 ans prévus pour 2025-2030, à cause des contestations juridiques et des réformes réglementaires.
Prochaines étapes
Si vous êtes dans l’industrie pharmaceutique : commencez à penser à votre stratégie de brevet de formulation dès le début du développement du médicament. Ne l’attendez pas jusqu’à l’expiration du brevet principal. La planification à long terme est la clé.
Si vous êtes un patient ou un professionnel de santé : demandez-vous si une nouvelle version d’un médicament apporte vraiment un bénéfice clinique, ou si elle est simplement une version brevetée pour éviter les génériques. Les données sont souvent accessibles - et elles méritent d’être examinées.
Si vous êtes un régulateur : les réformes en cours sont nécessaires. Mais il faut trouver un équilibre. Supprimer les brevets de formulation, c’est risquer de décourager les innovations réelles. Il faut cibler les abus, pas la science.
Caroline Vignal
26 12 25 / 22:20C’est fou comment on peut transformer un médicament en produit de luxe avec juste un nouveau comprimé. On appelle ça de l’innovation, mais c’est juste du marketing en blouse blanche. 🤦♀️
Cassandra Hans
28 12 25 / 12:52Je vais être honnête : ce système est un scandale... mais il est parfaitement légal. Les brevets de formulation ne sont pas des inventions, c’est du bricolage juridique... avec des essais cliniques bidon... et des chiffres manipulés... pour justifier des prix exorbitants... et ça, ça détruit la confiance... dans la médecine... vraiment...
olivier nzombo
30 12 25 / 01:19C’est quoi cette histoire de ‘picket fence’ ? 😂 On dirait un jardinier qui clôture son potager avec des cure-dents... Et les génériques, ils sont obligés de faire du sur-mesure pour éviter les piquets ? C’est du droit à la mode ‘Lego’... 😅
Raissa P
31 12 25 / 08:59On parle de santé, mais on joue à la bourse. Les laboratoires ne soignent plus les malades... ils spéculent sur leur souffrance. Et nous ? Nous sommes les cobayes du capitalisme médical. 🕊️💔
James Richmond
31 12 25 / 21:35Si les génériques pouvaient copier tout ça, ils le feraient. Le problème, c’est que les brevets sont trop précis. Trop de chiffres après la virgule. C’est pas de la science, c’est de la chasse au trésor.
theresa nathalie
2 01 26 / 11:51jai lu ca et jai rien compris mais jai compris ke cest pas normal... les labos ils font quoi avec nos sous ????
Pauline Schaupp
3 01 26 / 03:40Il est essentiel de reconnaître que cette stratégie, bien que critiquée, repose sur des fondements scientifiques solides. L’optimisation des formulations permet une meilleure observance thérapeutique, une réduction des effets indésirables, et une amélioration tangible de la qualité de vie. Ce n’est pas une manipulation, c’est une évolution nécessaire dans un système où chaque milligramme compte. Il faut distinguer l’abus de la véritable innovation, car l’une ne doit pas jeter le bébé avec l’eau du bain.
Nicolas Mayer-Rossignol
5 01 26 / 03:12Ah oui, bien sûr. ‘Une amélioration clinique significative’... sauf quand c’est un simple changement de sel et que ça coûte 500€ de plus. Bravo, vous avez gagné le prix Nobel de l’ironie. 🏆