Calculateur de réduction de risque
Cette calculatrice vous aide à comprendre ce que signifie réellement une réduction de risque de X % en termes concrets. Vous verrez la différence entre la réduction relative (le pourcentage annoncé) et la réduction absolue (le nombre de personnes concernées réellement).
Résultats
Cela signifie que sur 100 personnes traitées, le médicament réduit le risque de 0 personne(s).
Explication : Une réduction de 0 % semble impressionnante, mais en réalité, cela représente une différence de seulement 0 points de pourcentage.
Les étiquettes de médicaments souvent indiquent des réductions de risque relatives (ex: 38 %), mais ce chiffre peut être trompeur sans contexte. En connaissant le risque initial et la réduction absolue, vous pouvez mieux évaluer si les bénéfices justifient les risques.
Exemple concret : Si le risque initial de crise cardiaque est de 2 %, une réduction de 38 % ne passe le risque qu'à 1,24 %. Cela équivaut à réduire le risque de 0,76 point de pourcentage.
Que signifient vraiment les énoncés risque-bénéfice sur les étiquettes des médicaments ?
Vous avez peut-être déjà lu la petite section en bas de la notice d’un médicament, celle qui parle des « effets secondaires possibles » et des « avantages thérapeutiques ». Vous avez peut-être arrêté de lire après la première phrase, parce que tout semblait écrit en code. Ce n’est pas votre faute. Ces énoncés risque-bénéfice, publiés par la Food and Drug Administration (FDA), sont conçus pour guider les décisions médicales, mais trop souvent, ils ne parlent pas aux patients.
La FDA ne décide pas seulement si un médicament est sûr. Elle évalue si les bénéfices l’emportent sur les risques - et cela, pour une population entière. Mais ce que vous ressentez en prenant ce médicament, vous, avec votre corps, votre histoire, vos peurs, n’est pas toujours reflété dans ces lignes. C’est là que le problème commence.
Comment la FDA calcule-t-elle le risque et le bénéfice ?
Depuis décembre 2021, la FDA utilise un cadre officiel appelé le Benefit-Risk Framework. Ce n’est pas un simple tableau. C’est un processus rigoureux qui examine quatre axes : la maladie traitée, les traitements existants, les bénéfices observés et les risques identifiés. Chaque médicament est évalué en tenant compte du contexte : un traitement pour un cancer en phase terminale sera jugé différemment qu’un antidouleur pour une migraine.
Les données viennent des essais cliniques : combien de patients ont vu leur survie augmenter ? Combien ont eu une crise cardiaque ? Quel pourcentage a dû arrêter le traitement à cause d’effets secondaires ? La FDA regroupe tout cela dans un résumé intégré, exigé par la loi (21 CFR 314.50). Mais ce résumé, souvent rédigé par des scientifiques pour des scientifiques, ne dit pas grand-chose à un patient qui ne connaît pas les termes comme « réduction relative du risque » ou « intervalle de confiance ».
Pourquoi les patients ne comprennent pas ces énoncés ?
Une étude menée par le National Health Council en octobre 2022 a révélé que seulement 22 % des patients se sentaient « très confiants » pour interpréter ces informations. Pour ceux avec une faible littératie en santé, ce chiffre tombe à 9 %. Pourquoi ? Parce que les étiquettes utilisent des chiffres qui trompent.
Par exemple, une notice peut dire : « Ce médicament réduit le risque de crise cardiaque de 38 % ». Cela semble impressionnant. Mais si le risque initial était de 2 %, une réduction de 38 % signifie qu’il passe à 1,24 %. C’est un bénéfice réel, mais pas aussi dramatique qu’il y paraît. Les patients entendent « 38 % » et pensent qu’ils ont 38 chances sur 100 de ne pas avoir de crise. Ce n’est pas ce que ça veut dire.
Un autre problème : les risques sont souvent listés comme « réaction allergique rare » ou « risque de troubles hépatiques ». Mais « rare » veut dire quoi ? 1 cas sur 1 000 ? 1 sur 10 000 ? Sans chiffres concrets, c’est du flou. Et pourtant, c’est ce que les patients doivent utiliser pour décider s’ils prennent ou non le médicament.
Des exemples qui fonctionnent : ce que la FDA fait bien
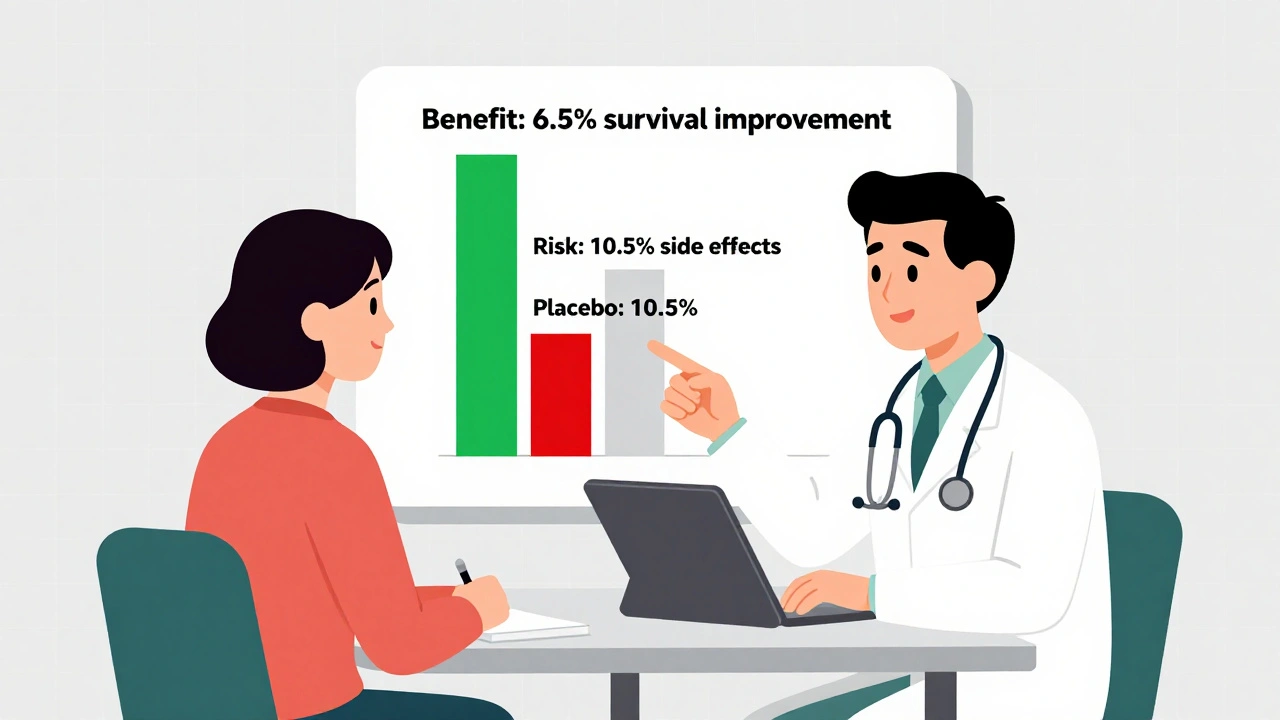
Il existe des exceptions. Le médicament Jardiance, utilisé pour le diabète de type 2 chez les patients ayant une maladie cardiaque, inclut une phrase claire dans son étiquette : « Chez les adultes avec diabète de type 2 et maladie cardiovasculaire, JARDIANCE a réduit le risque de décès cardiovasculaire de 38 % (10,5 % avec placebo contre 6,5 % avec JARDIANCE). »
C’est un bon exemple. Pourquoi ? Parce qu’il donne deux chiffres concrets : ce que ça donne sans le médicament, et ce que ça donne avec. Le patient peut voir la différence. Il n’a pas besoin d’interpréter un pourcentage relatif. Il voit la réalité : 10,5 sur 100 meurent d’une crise cardiaque sans le médicament. 6,5 sur 100 avec. C’est une différence de 4 points sur 100. C’est compréhensible. C’est humain.
Un autre exemple : les traitements contre le cancer. Les étiquettes de ces médicaments incluent souvent des données de survie : « Augmente la survie moyenne de 4,2 mois » ou « Réduit le risque de progression de la maladie de 52 % ». Ces chiffres sont durs, mais précis. Les patients atteints de cancer savent ce que signifie un mois de plus. Ils peuvent peser ce gain contre les nausées, la fatigue, les hospitalisations.
Les lacunes : quand les bénéfices sont flous
Les choses se compliquent avec les médicaments pour la dépression, l’anxiété ou la schizophrénie. Les bénéfices ne sont pas mesurables en mois de vie ou en taux de mortalité. Ils sont subjectifs : « je me sens moins angoissé », « je dors mieux », « je n’ai plus de voix dans ma tête ». Les risques, eux, sont bien réels : prise de poids, somnolence, troubles sexuels, risque de mouvements involontaires.
Dans ces cas, les étiquettes utilisent des phrases vagues : « Les effets indésirables courants incluent la somnolence et la bouche sèche ». Mais combien de patients les ressentent vraiment ? 1 sur 5 ? 1 sur 2 ? On ne le sait pas. Et on ne dit pas comment ces effets se comparent à d’autres traitements. Le patient est donc forcé de deviner : est-ce que la somnolence vaut la paix mentale ? Est-ce que je préfère être fatigué ou en crise d’anxiété ?
C’est ici que le cadre de la FDA bute. Il ne peut pas quantifier une amélioration de la qualité de vie. Il ne peut pas dire si un patient préfère prendre un risque de prise de poids pour éviter un hospitalisation psychiatrique. Pourtant, c’est exactement ce que les patients doivent décider.
Que fait la FDA pour améliorer les choses ?
La FDA sait que les choses doivent changer. Depuis 2019, elle a lancé une initiative appelée Patient-Focused Drug Development. Elle a recueilli plus de 1 200 commentaires de patients. Et ce qu’ils ont dit est clair : 78 % veulent des explications claires sur comment le médicament compare aux autres traitements. 63 % veulent des graphiques ou des icônes pour voir visuellement les bénéfices et les risques.
En septembre 2023, elle a lancé un programme pilote : six nouveaux médicaments contre le cancer doivent maintenant inclure une section appelée Patient Benefit-Risk Summary. Cette section est écrite au niveau de lecture d’un élève de 6e année. Elle utilise des icônes : une flèche vers le haut pour les bénéfices, une flèche vers le bas pour les risques. La taille de la flèche montre l’importance du gain ou du risque. Pas de chiffres complexes. Pas de jargon. Juste une image.
Elle travaille aussi avec la Bibliothèque nationale de médecine des NIH pour créer des icônes standardisées. Un cœur vert pour les bénéfices cardiaques, un foie jaune pour les risques hépatiques, un cerveau bleu pour les effets neurologiques. Ces icônes sont testées dans 12 centres cliniques avec 1 500 patients. Les premiers résultats sont prometteurs : les patients comprennent mieux, et ils se sentent plus impliqués dans leur décision.
Que pouvez-vous faire, vous, en tant que patient ?
Ne vous contentez pas de lire la notice. Posez des questions.
- Quel est le risque réel de cet effet secondaire ? Pas « rare » - combien de personnes sur 100 le vivent ?
- Comment ce médicament compare-t-il à d’autres options ? Est-ce qu’il réduit vraiment le risque de décès, ou seulement la pression artérielle ?
- Qu’est-ce que ça change dans ma vie quotidienne ? Est-ce que je vais être plus fatigué ? Plus en forme ?
- Si je ne prends pas ce médicament, qu’est-ce qui risque de se passer ?
Apportez la notice à votre médecin. Dites-lui : « Je n’ai pas compris cette partie. Pouvez-vous m’expliquer en termes simples ? » Un bon médecin saura vous répondre. S’il ne le fait pas, cherchez un autre avis.
Et si vous êtes un proche, un aidant, un parent : ne laissez pas la personne que vous aidez se débattre seule avec ces mots. Aidez-la à les décrypter. Parfois, un simple « qu’est-ce que ça veut dire, exactement ? » peut sauver une décision.
Et demain ? Ce que les experts prédisent
Les analystes de Evaluate Pharma prédisent qu’en 2026, 45 % des nouvelles étiquettes de médicaments incluront des résumés visuels. C’est un bond énorme : en 2022, ce n’était que 8 %. La pression vient des patients, des régulateurs, et même des entreprises pharmaceutiques. Elles ont compris : une bonne communication réduit les arrêts de traitement, les hospitalisations, les plaintes.
La FDA ne veut plus que les patients se sentent perdus. Elle veut qu’ils comprennent. Pas qu’ils soient des experts. Juste qu’ils sachent ce qu’ils prennent, pourquoi, et ce que ça peut leur coûter - ou leur apporter.
Le changement est lent. Mais il est en marche. Et chaque patient qui pose une question, qui demande une explication, qui refuse de se contenter du jargon, fait avancer ce changement.
Pourquoi les énoncés risque-bénéfice sont-ils si difficiles à comprendre ?
Ils sont écrits pour des scientifiques, pas pour des patients. Les termes techniques, les pourcentages relatifs, l’absence de comparaisons concrètes et le manque de chiffres absolus rendent ces énoncés confus. Par exemple, dire qu’un médicament « réduit le risque de 38 % » ne dit pas combien de personnes sont réellement concernées. Sans contexte, ce chiffre peut être trompeur.
Qu’est-ce qui distingue la FDA des autres agences comme l’EMA ?
La FDA utilise un cadre flexible et qualitatif, tandis que l’Agence européenne des médicaments (EMA) privilégie une approche plus quantitative, comme la méthode PrOACT-URL. L’EMA a aussi intégré plus tôt les préférences des patients dans ses évaluations, ce qui a aidé à mieux communiquer sur les vaccins contre la COVID-19. La FDA, elle, s’adapte mieux à des domaines variés comme l’oncologie, mais manque de standardisation pour les maladies psychiatriques.
Les icônes et les graphiques dans les étiquettes vont-ils vraiment aider ?
Oui, et des tests sont déjà en cours. Les premières icônes visuelles - comme des flèches de taille variable pour montrer l’ampleur des bénéfices ou des risques - ont augmenté la compréhension chez les patients dans les essais cliniques. Les patients disent qu’ils comprennent plus vite, se sentent moins stressés, et prennent des décisions plus confiantes. Ce n’est pas une mode : c’est une nécessité pour une information médicale réellement accessible.
Comment savoir si un bénéfice est réel ou exagéré ?
Demandez toujours les chiffres absolus. Si un médicament dit « réduit le risque de 50 % », demandez : « Sur combien de personnes ? » Si le risque initial était de 2 %, une réduction de 50 % ne fait que le baisser à 1 %. C’est un bénéfice, mais pas un miracle. Comparez aussi avec les traitements alternatifs. Un bénéfice réel se mesure à la différence de résultat entre ce que vous avez maintenant et ce que vous aurez avec le nouveau traitement.
Les patients peuvent-ils influencer la façon dont les risques et bénéfices sont présentés ?
Oui. Depuis 2019, la FDA collecte activement les retours des patients via son programme Patient-Focused Drug Development. Des milliers de commentaires ont conduit à des changements concrets : l’obligation de résumer les bénéfices et risques en langage simple, l’expérimentation d’icônes visuelles, et même la demande de données sur les préférences des patients pour certains médicaments. Votre voix compte - si vous la faites entendre.
Que faire maintenant ?
Ne laissez pas la complexité vous arrêter. Quand vous recevez une nouvelle ordonnance, prenez deux minutes pour regarder la notice. Cherchez les chiffres concrets. Posez une question à votre médecin. Si vous ne comprenez pas, demandez une explication plus simple. Il n’y a pas de honte à ne pas comprendre du jargon médical - c’est conçu pour être incompréhensible.
Et si vous êtes un proche, un parent, un aidant : aidez. Lisez avec la personne. Posez les mêmes questions. Parfois, ce n’est pas une question de compréhension médicale - c’est une question de confiance. Et la confiance, elle se construit avec des mots clairs, des chiffres réels, et des réponses honnêtes.
Oumou Niakate
5 12 25 / 01:00J’ai lu la notice de mon anti-dépresseur hier… j’ai cru qu’on m’envoyait un rapport de la NASA. 38 % de réduction ? Mais de quoi exactement ? J’ai juste envie de dormir sans me sentir coupable.
Laurent REBOULLET
5 12 25 / 12:19Je suis médecin, et je vois tous les jours des patients qui paniquent parce qu’ils lisent ‘risque rare de troubles hépatiques’. Mais ‘rare’ = 1 sur 5000 ? 1 sur 100 ? Personne ne le sait. La FDA devrait être obligée de mettre des chiffres réels, pas des euphémismes. C’est une question de vie ou de mort, pas de marketing.
Estelle Trotter
6 12 25 / 04:18Ah oui bien sûr, la FDA, cette agence américaine qui nous vend des pilules comme des sacs de chips. En France, on a la HAS, et elle, elle sait ce qu’elle fait. Vous savez ce qu’on dit chez nous ? ‘Si tu veux comprendre un médicament, demande à ton pharmacien, pas à un algorithme de Washington.’
Patrice Lauzeral
7 12 25 / 15:55Je me demande… est-ce que tout ça ne fait qu’augmenter l’anxiété des patients ? On leur donne trop d’infos, et ils se perdent. Peut-être qu’un peu de mystère, c’est rassurant. Moi, je prends ce qu’on me donne, et je fais confiance. C’est plus simple.
Chanel Carpenter
8 12 25 / 04:21J’ai aidé ma mère à lire sa notice hier. On a mis 45 minutes. On a fait un tableau : ‘ce que ça fait’ vs ‘ce que ça coûte’. Elle a dit : ‘Ah, donc si je prends ça, je vais peut-être dormir mieux, mais je vais grossir.’ Et elle a souri. C’était la première fois qu’elle comprenait. Les icônes, oui. Les flèches, oui. Pas les pourcentages.
Sophie Burkhardt
8 12 25 / 19:59Je vous jure, c’est comme lire une recette de gâteau écrite par un génie fou qui a oublié les œufs. ‘Réduction relative du risque’ ? C’est du charabia pour faire peur ou pour impressionner. Moi, je veux savoir : si je prends ça, je vais être plus vivant ou plus mort ? Pas un chiffre qui danse sur un écran. J’ai envie de pleurer quand je vois ça. Les patients ne sont pas des statistiques. On est des humains.
Nicole Perry
9 12 25 / 20:52La vérité, c’est que la médecine moderne a perdu le sens du sacré. On réduit la vie à des courbes, à des p-values, à des intervalles de confiance. Mais qui a dit que la santé devait être quantifiée ? La souffrance ne se mesure pas en pourcentages. Et ce que la FDA fait là… c’est une forme de colonisation du corps. On nous dit ce qu’on doit penser de notre douleur… avec des graphiques.
Juliette Chiapello
10 12 25 / 19:39Les icônes sont une excellente idée 🌟! Moi j’ai pris un médicament pour l’anxiété et j’ai vu la flèche verte pour ‘amélioration du sommeil’ et la flèche rouge pour ‘gain de poids’… j’ai tout compris en 2 secondes. Le jargon, c’est du passé. On est en 2025, pas en 1987. 📊❤️
cristian pinon
12 12 25 / 07:28Il est essentiel de souligner que le cadre de bénéfice-risque de la FDA, tel que défini dans le 21 CFR 314.50, constitue un modèle normatif rigoureux, fondé sur des données probantes issues de protocoles randomisés en double aveugle, contrôlés par placebo, et analysés selon les principes de l’inférence statistique bayésienne. La simplification excessive, bien qu’émotionnellement attrayante, risque de compromettre l’intégrité épistémologique du processus décisionnel clinique. Il convient donc d’équilibrer accessibilité et rigueur scientifique.
Alain Guisolan
13 12 25 / 19:03Le vrai problème, c’est qu’on a oublié que la médecine, c’est une relation. Pas un algorithme. Quand un patient lit ‘risque de troubles hépatiques’, il ne voit pas un chiffre. Il voit la peur de mourir. Et si on lui disait : ‘Sur 100 personnes comme vous, 2 auront un problème au foie, mais 70 se sentiront mieux’… il choisirait. Il choisirait avec sa tête et son cœur. C’est ça qu’il faut. Pas des flèches. Des histoires.
Katleen Briers
14 12 25 / 10:06Ah oui, bien sûr. Les Américains vont nous apprendre à lire des notices. En France, on a les pharmaciens. Et ils disent : ‘Prenez-le, ça va aller.’ C’est plus efficace.
Kate Orson
15 12 25 / 23:46Les icônes ? C’est une couverture pour les vrais risques. La FDA travaille avec Big Pharma. Les flèches vertes cachent les effets à long terme. Vous croyez que c’est pour vous aider ? Non. C’est pour que vous ne posiez pas de questions. Regardez les études cachées. Les essais sur 10 ans ? Supprimés. Le silence est doré. 🕵️♀️💊
Nicole Gamberale
17 12 25 / 19:30Vous êtes tous des naïfs. Personne ne devrait prendre de médicaments. La nature guérit. La chimie tue. La FDA est une machine de propagande. Si vous voulez être en forme, mangez des graines de courge, respirez l’air pur, et arrêtez de croire aux pilules magiques. 🌿❌
Alexis Butler
19 12 25 / 18:34Je suis étonné que vous n’ayez pas mentionné le fait que l’EMA utilise une méthode PrOACT-URL bien plus robuste que le cadre de la FDA, qui est en réalité une version simplifiée et dérivée de la méthode de l’OMS de 2008. La FDA a adopté ce système en 2021 après une pression politique, pas scientifique. Et maintenant, on veut des icônes ? On va bientôt avoir des emojis pour les effets secondaires. C’est pathétique. Et vous, vous applaudissez ?